Dwutlenek wodoru
 Przytoczone wcześniej równanie, wyrażające tworzenie się wody przez działanie chlorowodoru na tlenek wapnia, może być uogólnione. Tlenek jakiegokolwiek metalu (M) z jakimkolwiek kwasem (kwasy zawierają w sobie zawsze wodór; oznaczając to, co oprócz wodoru znajduje się w kwasie przez X, możemy kwasy w ogóle przedstawiać za pomocą wzoru HX) ulega podwójnej wymianie, wydając wodę i sól.
Przytoczone wcześniej równanie, wyrażające tworzenie się wody przez działanie chlorowodoru na tlenek wapnia, może być uogólnione. Tlenek jakiegokolwiek metalu (M) z jakimkolwiek kwasem (kwasy zawierają w sobie zawsze wodór; oznaczając to, co oprócz wodoru znajduje się w kwasie przez X, możemy kwasy w ogóle przedstawiać za pomocą wzoru HX) ulega podwójnej wymianie, wydając wodę i sól.
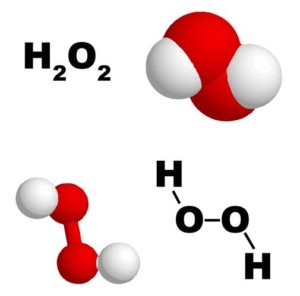
Znamy jednak metale, które, oprócz tlenków, tworzą jeszcze inne związki z tlenem, zwane dwutlenkami. Tak np. znamy tlenek wapnia Ca O i dwutlenek wapnia Ca O2 tlenek baru Ba O i dwutlenek baru Ba 02. O tym ostatnim wspomniano już dawniej, jako o materiale do wytwarzania tlenu. Dwutlenek liaru z chlorowodorem ulega podwójnej wymianie, której produktami są chlorek baru (sól) i dwutlenek wodoru. Między dwutlenkiem wodoru a wodą jest taka różnica, jak między dwutlenkiem a tlenkiem baru. Na 2 obj. wodoru woda zawiera 1 obj. tlenu a dwutlenek wodoru 2 objętości. Z powodu takiego składu, przedstawiającego jakoby wodę połączoną z tlenem, dwutlenek wodoru otrzymał także nazwisko wody utlenionej.
Woda utleniona w stanie bardzo słabego roztworu, o ile się zdaje, dość często zdarza się w przyrodzie. Woda deszczowa i śnieg mianowicie mają zawierać w sobie maleńkie ilości tego związku. W pracowniach otrzymuje się w stanie czystym z dwutlenku baru i kw. siarkowego albo jakiego innego kwasu. Stanowi ona ciecz bezbarwna, mniej ruchliwą niż woda i cięższą prawie 1,5 raza od tej ostatniej; zapachu nie ma a smak nieprzyjemny, cierpki. Dwutlenek wodoru zupełnie czysty krzepnie w bardzo niskiej temp. Na masę krystaliczną, topniejącą znowu w -2 stopni. Wrzeć prawidłowo może tylko pod bardzo niskim ciśnieniem, i w tych warunkach bywa destylowany w celu zupełnego oczyszczenia. Ogrzewany po ciśn. zwykłem ulega rozkładowi. Rozkład taki odbywa się z wolna już w temp. zwyczajnej, a w 100 stopni jest bardzo szybki-tlen wydziela się niekiedy tak gwałtownie, że aż wybuch następuje. 1 cm3 dwutlenku wodoru wydziela w normalnych warunkach 477 cm3 tlenu. Jeszcze łatwiej dwutlenek wodoru rozkłada się w zetknięciu z ciałami, które wydzielający się z niego tlen mogą przyłączyć do siebie. Różne ciała sprzyjają podobnemu rozkładowi, tak np. czarny siarczek ołowiu (ołów, siarka) przyłącza tlen z dwutlenku wodoru, dając biały siarczan ołowiu (ołów, siarka, tlen), czerwony kwas chromowy zachowuje się podobnież, dając niebieski kwas nadchromowy, bogatszy w tlen itd. Dwutlenek wodoru jest przeto ciałem utleniającym.
Ponieważ dwutlenek wodoru łatwo się rozkłada, uważamy go przeto za związek nietrwały, a ponieważ rozkładając się wydziela połowę zawartego w sobie tlenu, wnioskujemy przeto, że ta połowa jest mniej trwało połączona z wodorem, aniżeli druga. Takich związków nietrwałych poznamy następnie znaczną liczbę; tu wspominamy tylko, że pomiędzy związkami tlenu znamy wiele, podobnych z nietrwałości do wody utlenionej – do takich między innymi należą tlenki metali szlachetnych. Otóż jest rzeczą ciekawą, że nietrwałość wody utlenionej usposabia do rozkładu rozmaite tlenki metali, tak, że kiedy zetkniemy z nią np, tlenek srebra, to następuje wydzielenie tlenu i z wody utlenionej i z tlenku srebra a w rezultacie pozostaje srebro metaliczne i woda zwyczajna. Podobnie nadmanganian potasu (sól złożona z manganu, potasu i tlenu) pod wpływom dwutlenku wodoru traci część tlenu i przechodzi w mieszaninę tlenku manganu i wodzianami potasu a współcześnie dwutlenek wodoru zamienia się na wodę. Tak więc dwutlenek wodoru może wpływać na stratę tlenu w pewnych jego związkach, czyli może działać sposobem odtleniającym.
Własności chemiczne dwutlenku wodoru, a w szczególności zdolność jego utleniająca, sprawiają, że ma on dość ważne zastosowania przemysłowe. Używa się mianowicie do mielenia piór, gąbek, kości słoniowej itp., a także w stanie czystym i rozcieńczony wodą bywa używany w medycynie.